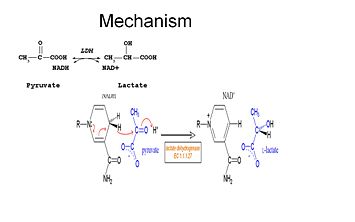
La L-lattato deidrogenasi (o LDH) è un enzima, appartenente alla classe delle ossidoreduttasi, che catalizza la seguente reazione:
piruvato NADH H ⇄ (L)-lattato NAD
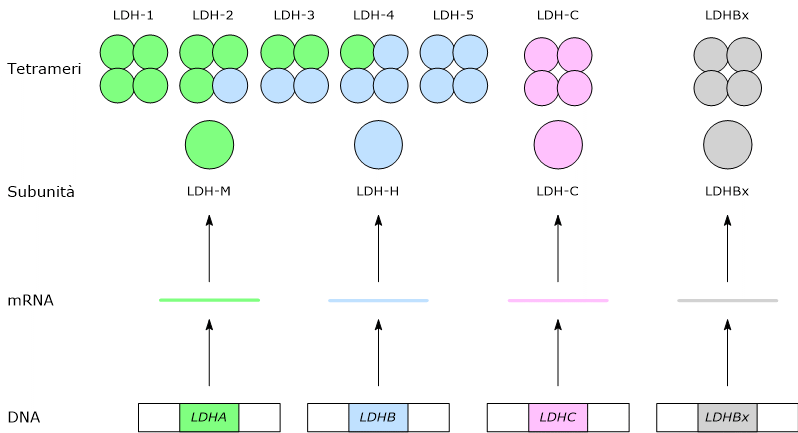
LDH è un tetramero formato dalla combinazione di due diversi monomeri, codificati da due geni distinti: il tipo H (H dall'inglese heart), maggiormente presente nel cuore, e il tipo M (M dall'inglese muscle), caratteristico del muscolo scheletrico. Dalla diversa composizione monomerica, si hanno cinque forme isoenzimatiche: H4 o LDH1, H3M1 o LDH2, H2M2 o LDH3, H1M3 o LDH4, M4 o LDH5 che differiscono tra loro per composizione strutturale, proprietà biochimiche e diffusione tissutale.
Distribuzione degli isoenzimi
- LDH1 (H4) è prevalente nel miocardio e nei globuli rossi. Presente anche nella corteccia renale e nel muscolo scheletrico.
- LDH2 (H3M1) è prevalente nel miocardio e nelle emazie, oltre ad essere presente nel pancreas, corteccia renale, polmone e muscolo scheletrico.
- LDH3 (H2M2) è presente in polmoni, placenta, muscolo scheletrico e pancreas.
- LDH4 (H1M3) si trova nella midollare renale, muscolo scheletrico, polmone e placenta.
- LDH5 (M4) è caratteristico del muscolo e del fegato. Presente anche nella midollare renale e nel pancreas.
Patologia clinica
Valori normali nel siero sono considerati compresi tra 0-600 U/L e 800-3600 UI/L nelle urine (nota: autori diversi indicano intervalli differenti). In termini di rapporto fra isoenzimi, valori normali sono considerati: LDH1 18-30%, LDH2 28-30%, LDH3 15-30%, LDH4 6-16%, LDH5 2-13%. Valori anomali di LDH1 e LDH2 si riscontrano nell'infarto miocardico e nell'anemia emolitica. In particolare il livello di LDH1, a seguito di infarto del miocardio, raggiunge il picco dopo 48 h e rimane alterato per 1-3 settimane. LDH3 aumentato è in relazione con l'infarto polmonare mentre un maggiore quantitativo di LDH5 è caratteristico dell'epatite virale acuta.
Riassumendo, un livello di LDH totale maggiore della norma si riscontra in patologie come: infarto miocardico, infarto polmonare, epatite virale acuta, epatite tossica, stato di shock, anemia severa, distrofia muscolare, polimiosite, dermatomiosite, esercizio muscolare intenso, diabete, insufficienza renale, cirrosi epatica, sindrome di Reye, leucemia e neoplasie. Valori diminuiti si riscontrano in soggetti esposti a radiazioni ionizzanti.
Bibliografia
- Dennis, D. and Kaplan, N.O. D and L-lactic acid dehydrogenase in Lactobacillus plantarum. J. Biol. Chem. 235 (1960) 810–818. Entrez PubMed 13815938
- Everse, J. and Kaplan, N.O. Lactate dehydrogenases: structure and function. Adv. Enzymol. Relat. Subj. Biochem. 37 (1973) 61–133. Entrez PubMed 4146647
- Holbrook, J.J., Liljas, A., Steindel, S.J. and Rossmann, M.G. Lactate dehydrogenase. In: Boyer, P.D. (Ed.), The Enzymes, 3rd edn, vol. 11, Academic Press, New York, 1975, pp. 191–292.
- Schär, H.-P. and Zuber, H. Structure and function of L-lactate dehydrogenases from thermophilic and mesophilic bacteria. I) Isolation and characterization of lactate dehydrogenases from thermophilic and mesophilic bacilli. Hoppe-Seyler's Z. Physiol. Chem. 360 (1979) 795–807. Entrez PubMed 114469
Altri progetti
- Wikimedia Commons contiene immagini o altri file su L-lattato deidrogenasi
Collegamenti esterni
- (EN) lactate dehydrogenase, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.